中国之声丨糖尿病黄斑水肿新机制-水通道蛋白11的作用及靶向干预
编者按
糖尿病视网膜病变(diabeticretinopathy,DR)是全球性工作人群致盲的主要眼病之一。其中,糖尿病黄斑水肿(Diabeticmacularedema,DME)可出现在DR的任意阶段,且DME是目前影响糖尿病患者视力的最主要原因。作为DME治疗的金标准,抗VEGF药物对大部分患者有效,但仍有部分患者反应欠佳,提示除VEGF外,其他发病因素也参与了DME的形成。上海市第一人民医院眼科张敬法教授、孙晓东教授团队联合同济大学医学院徐国彤教授团队,近期对水通道蛋白11(Aquaporin11,AQP11)在视网膜和Müller细胞中的功能作用进行了探索并取得了成果,该研究以“Aquaporin11alleviatesretinalMüllerintracellularedemathroughwatereffluxindiabeticretinopathy”为题,发表在药学专业期刊PharmacologicalResearch上(IF=10.334)。

研究背景
DME的发病机理十分复杂,Starling定律表明主要有以下两方面原因:血-视网膜屏障(Blood-retinalbarrier,BRB)破坏所导致的视网膜渗漏增加,以及Müller细胞和视网膜色素上皮细胞(Retinalpigmentepithelium,RPE)引流功能障碍所导致的视网膜排水减少。具体来说,Müller细胞主要负责将视网膜内的水转运至视网膜血管和玻璃体腔,而RPE细胞主要负责将视网膜下腔的水转运至脉络膜,二者共同保持了视网膜相对“干”的状态;但在病理状态下,这两类细胞的排水功能障碍会导致视网膜内多余水分无法排出。其中,Müller细胞功能失调将导致Müller细胞性水肿,并加重视网膜黄斑水肿。需要注意的是:当前的临床治疗主要针对BRB的破坏(堵漏策略),却忽略了视网膜排水功能的障碍(疏通策略)。因此,从“疏通”角度改善或提高Müller细胞的排水功能为DME的治疗提供了一个新策略。
水通道蛋白(Aquaporin,AQP)表达在细胞膜或细胞器膜上,可促进水分子及其他小分子的跨膜运输,具有快速调节细胞内部渗透压并维持细胞自身体积的作用。目前,关于Müller细胞调节视网膜水平衡的研究大多聚焦在AQP4和。而AQP超家族成员AQP11在视网膜和Müller细胞中的功能并不清楚,特别是在DME中的作用尚未报道。
研究结果
第一作者张朝阳博士利用STZ诱导的糖尿病大鼠模型、低氧诱导的rMC-1细胞水肿模型,以及DR临床样本,研究了AQP11的功能、表达及其失调的分子机制。
动物实验显示:
AQP11主要定位在大鼠视网膜Müller细胞的终足上,其表达量随着糖尿病的进展而下调,并伴有Müller细胞性水肿;
玻璃体注射慢病毒介导的AQP11过表达系统(LV-AQP11)可以有效缓解糖尿病大鼠Müller细胞性水肿。
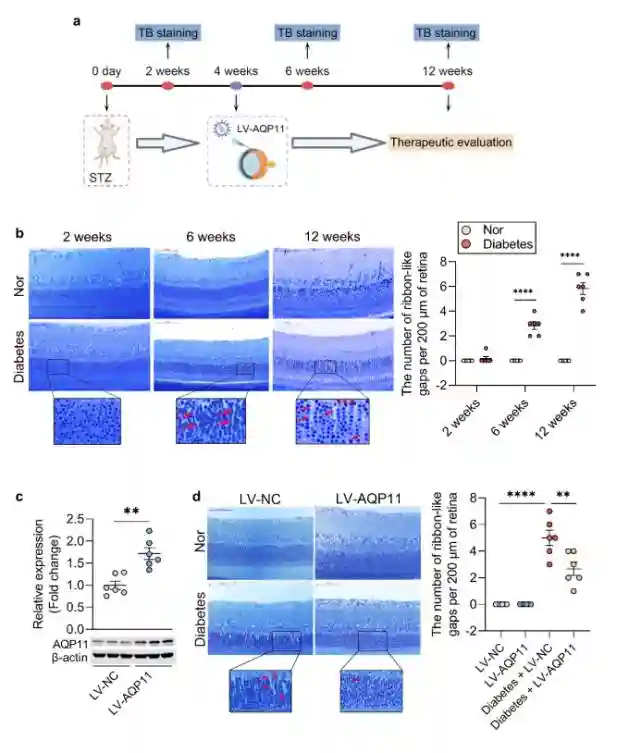
图1.玻璃体腔注射LV-AQP11有效抑制了糖尿病大鼠视网膜Müller细胞性水肿
细胞实验进一步验证了动物实验的结果,具体如下:
在低氧诱导的rMC-1细胞水肿模型中,抑制AQP11的表达/功能使细胞水肿进一步加重;
在低氧诱导的rMC-1细胞水肿模型中,过表达AQP11可有效减轻其水肿;同时,Müller的谷氨酸代谢功能明显改善、细胞凋亡显著减少;
在低渗诱导的细胞水肿模型中,过表达AQP11的rMC-1细胞表现出更快的排水功能。
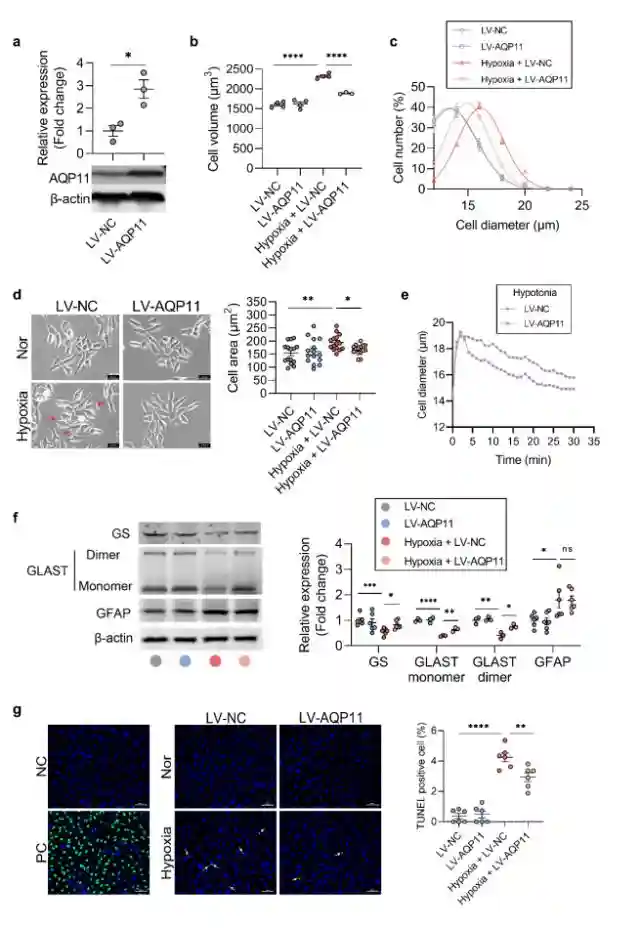
图2.过表达AQP11对rMC-1细胞水肿、功能和细胞死亡的影响
分子机制方面,张教授及其团队通过生物学预测、分子生物学筛选、双荧光素酶报告基因检测、分子生物学验证,以及生物信息学分析等手段发现“miRNA-AQP11”介导了糖尿病视网膜Müller中AQP11的下调(详见原文),具体结果如下:
HIF-1α依赖途径介导AQP11下调,即“HIF-1α-miR-27b/107–3p-AQP11”信号轴;
HIF-1α非依赖途径介导AQP11下调,即“miR-15–5p-AQP11“信号通路;
AQP11上游miRNAs组合在DR中的潜在生物学功能富集在“膜运输“和”VEGF-VEGFR通路“上。
张教授及其团队研究发现,AQP11下调是导致糖尿病大鼠视网膜Müller细胞水肿的原因之一;而过表达AQP11增强了Müller细胞的外排水功能,进而减轻了Müller细胞性水肿和视网膜水肿。
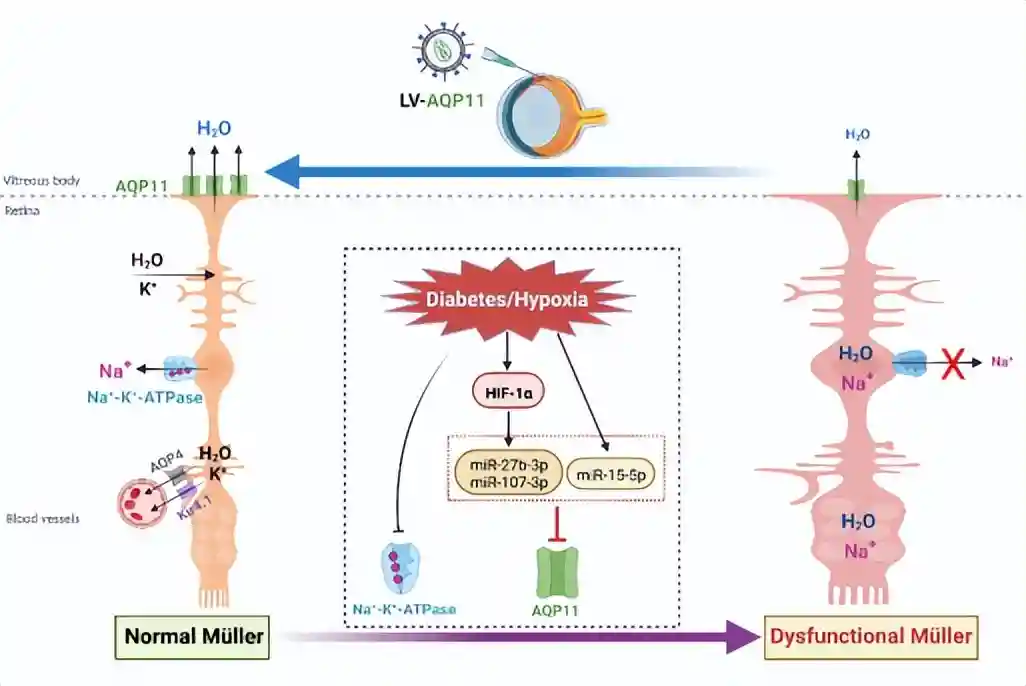
图3
研究结论
本研究结果提示:糖尿病视网膜中HIF-1α依赖/非依赖的miRNAs信号通路激活靶向抑制了Müller细胞AQP11的表达,进而引起Müller细胞排水功能障碍,最终导致Müller细胞性水肿;Müller细胞水肿及其功能异常可通过过表达AQP11得以显著改善。张教授及其团队的研究为DME提出了一种新机制,因此针对AQP11或Müller排水进行靶向调控为DME患者提供了一种替代或补充疗法(图4)。
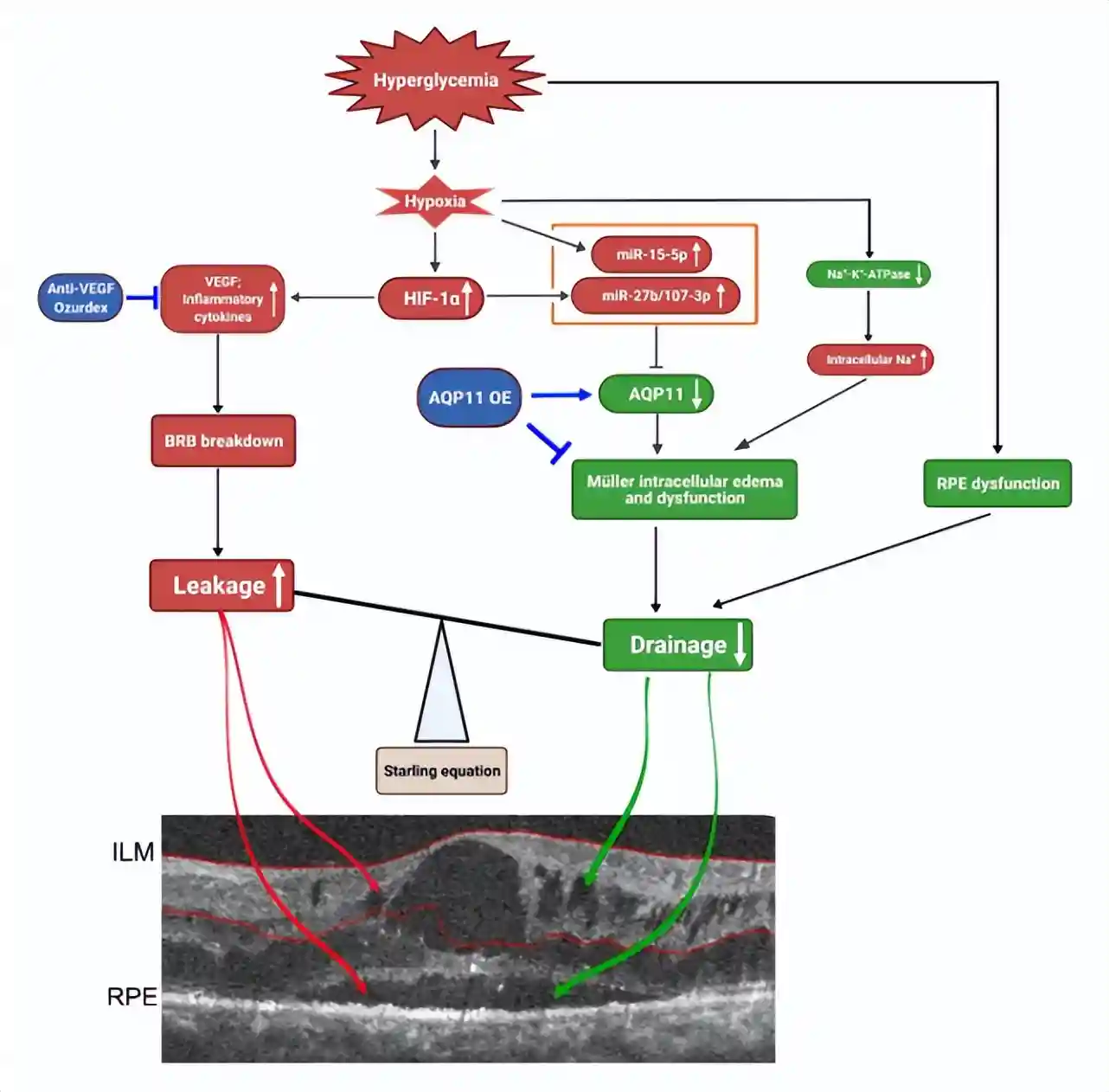
图4.DME机制图(绿色为本研究聚焦方向)

张敬法教授
上海市眼科研究所副所长。研究员,副主任医师,博士研究生导师,哈佛大学医学院博士后,上海市浦江人才。中国医师协会眼科医师分会第五届委员会基础研究与临床转化副主任委员(兼秘书)、中国老年医学学会眼科分会青年委员会副主任委员、上海市生物医药行业协会精准医疗专业委员会常委等。临床及科研方向为眼底病发病机制及治疗,聚焦糖尿病视网膜病变和年龄相关性黄斑变性。
徐国彤教授
共同通讯作者
医学博士、药学博士。同济大学特聘教授、同济大学新生院济人学堂执行院长、同济大学医学眼科研究所所长、华东干细胞库主任。曾任同济大学生命医学学部副主任和医学院院长。
主要研究老年性眼病和衰老机制以及抗衰老研究。包括视网膜变性的干细胞治疗、白内障发病机制及药物治疗,糖尿病视网膜病变发病机制和创新疗法研发。
先后负责和参加国家级科研项目十余次(包括两次担任重大科学研究计划干细胞项目的首席科学家和一次国际合作重大项目的首席科学家),发表研究论文150余篇,包括在国际期刊发表的论文约120篇,被引用逾2000次;主编/副主编干细胞及眼科专著和教材5本,申请专利约30余项且大部分已获授权;中国细胞生物学学会干细胞生物学分会首任会长、理事,中国医师协会眼科分会基础研究与临床转化学组组长、海医会眼科分会常委及干细胞学组组长等。担任CurrMolMed、《中华细胞与干细胞杂志》等杂志副主编。获中美眼科和视觉研究贡献奖、卫生部有突出贡献中青年专家、宝钢优秀教师奖、第47届日内瓦国际发明展银奖等。
孙晓东教授
共同通讯作者
主任医师,教授,博士生导师,教育部“长江学者”特聘教授、国家杰出青年科学基金获得者。现任上海交通大学附属第一人医院副院长、眼科中心主任、上海眼科学会候任主任委员,中华眼科学会委员、眼底病学组委员、中国眼科医师协会委员、中华眼科学会专家会员、美国AERS委员、AAO、ARVO国际会员以及中华系列等7本专业学术期刊编委等。
主要从事视网膜脱离、糖尿病视网膜病变、老年黄斑变性等眼底疾病诊治与显微外科手术,并围绕上述眼底病的关键致盲机制展开研究工作。作为项目负责人先后主持科技部“十三五”重大、国家自然科学基金重点项目和杰出青年基金等10项国家级课题,共发表论文160余篇;先后获得上海市科技进步一等奖、国家科学技术进步二等奖、中华医学科技二等奖、教育部科技进步二等奖等10项科技学术奖励。
张朝阳博士
上海市第一人民医院眼科科研助理。科研方向为糖尿病视网膜病变和年龄相关性黄斑变性的发病机制及治疗。共发表SCI论文22篇,其中以第一作者发表在InvestOphthalmolVisSci、PharmacolRes、ClinExpOphthalmol等杂志上。